高盐镍氨废水净化及深度脱除镍技术
1、引言
作为锂离子电池的核心材料,三元前驱体生产常采用氨碱配合湿法连续共沉淀法,以硫酸镍(钴、锰)为原材料,氨水为配合剂,氢氧化钠为沉淀剂。其生产过程产生大量废水,主要成分为硫酸钠、氢氧化钠、氨氮、重金属镍等。随着国家对环保的越发重视,污染控制愈发严格,对此类废水的治理提出了新的要求。根据《电池工业污染物排放标准》(GB30484-2013)要求,自2016年起,所有企业镍的排放均满足0.5mg/L的限值。
鉴于该废水具有高盐、含镍、含氨氮等特性,目前主要采取解络合精馏+MVR除盐、硫化物沉淀+多效蒸发除盐、硫化物沉淀+磷酸铵镁除氨+冷冻结晶法、硫化物沉淀+磷酸铵镁除氨+MVR除盐等。对于高盐含镍氨废水体系中镍的净化机理研究,主要集中在[Me]-H2O体系、NH3-H2O体系、[Me]-NH3-H2O体系等,而对于[Me]-NH3-Na2SO4-H2O体系鲜有报道。本文根据热力学分析,结合PHREEQC热力学模拟软件,基于实际废水处理工艺,分析高盐镍氨废水处理过程中镍的净化机理,为此类废水的治理提供理论依据。
2、废水处理工艺
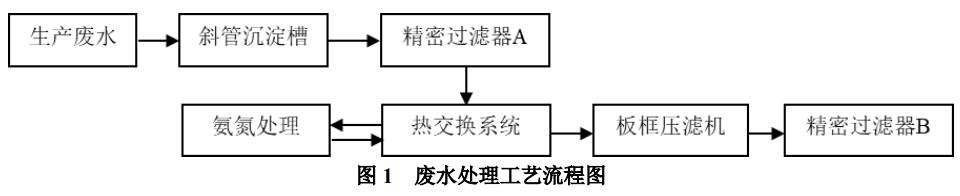
图示为某企业三元前驱体生产废水的处理工艺,采用“解络合+蒸氨”工艺深度去除金属镍和氨氮。该废水通过斜管沉降槽进行预处理,大部分重金属由于重力沉降作用,停留在沉降槽底部,溢流通过中间储槽,泵入精密过滤器A,进行过滤预处理,滤液通过中间储槽,泵送至废水线的废水储罐。精馏塔后,由于氨氮浓度降低至15mg/L,溶液中的重金属离子转变为沉淀,再次通过精密过滤器进行精滤,降低废水中重金属的含量,精滤液经pH调节池降温和调pH值6~9,然后外排。
因此,结合废水的工艺及水质特点,将镍的沉淀过程分为三个阶段:
(1)废水预处理阶段,即斜管沉淀→精密过滤器A,废水成分为:Na2SO4含量60~80g/L,氨氮含量3~6g/L。
(2)汽提脱氨阶段,即精馏塔→板框压滤机,废水成分为:Na2SO4含量60~80g/L,氨氮含量15mg-3g/L。
(3)深度净化阶段,即精密过滤器B,废水成分为:Na2SO4含量60~80g/L,氨氮含量15mg以下,水温80~100℃。
3、废水体系热力学分析
该高盐含镍氨废水体系中存在的物质有:Ni(NH3)i2+(i=0,1,2,3,4,5,6)、Ni(OH)j2-j(j=1,2,3)、NH3、NH4+、H+、OH-和H2O。假设溶液中氨氮浓度为[NH3]T,游离的二价镍离子浓度为[Ni2+]T,根据电荷平衡及质量守恒原理,可得出不同氨氮浓度下镍离子与pH值的关系,如下图2所示。
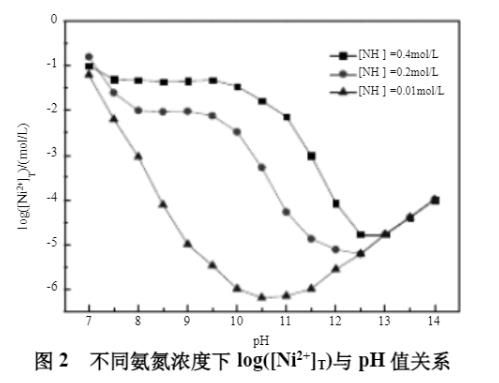
由图2可知,在[NH3]T浓度0.01~0.4mol/L时,体系中[Ni2+]T浓度随着[NH3]T含量的减少而减少。这是由于氨对Ni2+的配合作用,影响Ni2+与OH-的沉淀反应。在体系pH值7~14时,[Ni2+]T浓度随pH值的升高,先减少后逐渐增加。这是由于pH值的增加,体系中的镍以Ni(OH)2存在;而随着pH值的继续增大,Ni(OH)2在氨水中反溶引起[Ni2+]T浓度增加。因此,该体系中[NH3]T浓度、pH值对[Ni2+]T起决定作用。
4、废水体系PHREEQC软件模拟分析
PHREEQC热力学模拟软件,是基于溶液化学中的反应平衡、“质量守恒”和“电子守恒”。水溶液化学反应体系包括:初始溶液、气固相、溶液中不同价态元素间的各类反应、气固相的溶解平衡等。初始溶液由各种价态的元素构成,其定义为元素类别、元素的价态、元素的主要存在形式、元素的物质量、溶液温度、溶液pH值以及电子活度pe等。
4.1 预处理阶段废水系统中镍的形态分析
初始模拟条件:[NH3]T浓度300mmol/L;[Na2SO4]T浓度0.5mol/L;[Ni2+]T浓度5mg/L;水温50℃。不同pH值下溶液中镍的平衡浓度见图3所示,镍的形态分布曲线见图4。
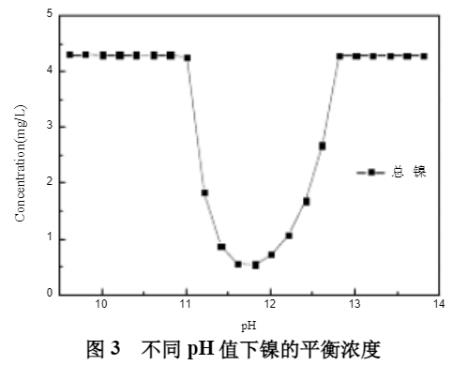
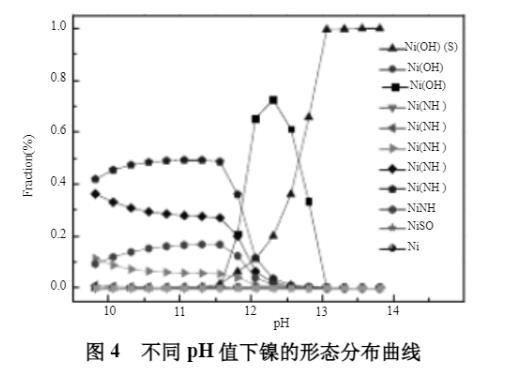
从图3可知,pH值在11.0时,镍开始沉淀;在pH值为11.6时,[Ni2+]T浓度最低,为0.5mg/L。从图4可知,pH小于11.6时,镍主要以镍氨络合态Ni(NH3)22+、Ni(NH3)32+、Ni(NH3)42+、Ni(NH3)52+、Ni(NH3)42+存在;当pH值大于11.6时,镍开始沉淀,形成Ni(OH)2(s)的沉淀,同时与OH-形成络合态Ni(OH)3-,在pH值为13.1时,大约有96%的镍以Ni(OH)2(s)的沉淀存在。因此,在此阶段中,最低可将镍沉淀至0.5mg/L。
4.2 蒸氨阶段废水系统中镍的形态分析
初始模拟条件:[NH3]T浓度300mmol;[Na2SO4]T浓度0.5mol/L;[Ni2+]T浓度5mg/L;水温90℃。水温在90℃时,溶液的pH值最大不超过12.0,因此,在90℃时废水体系镍的沉淀模拟时,pH值的范围为8.0~12.0。不同pH值下溶液中镍的平衡浓度见图5所示,镍的形态分布曲线见图6。
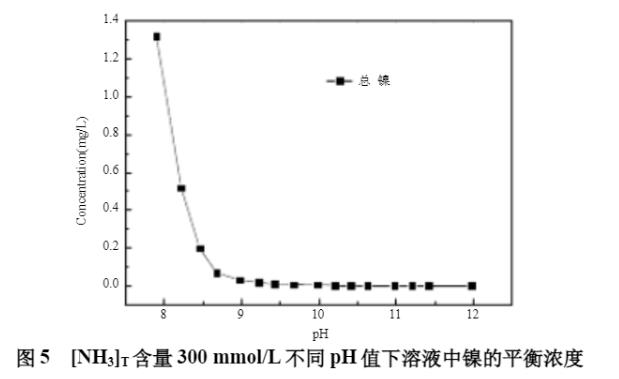
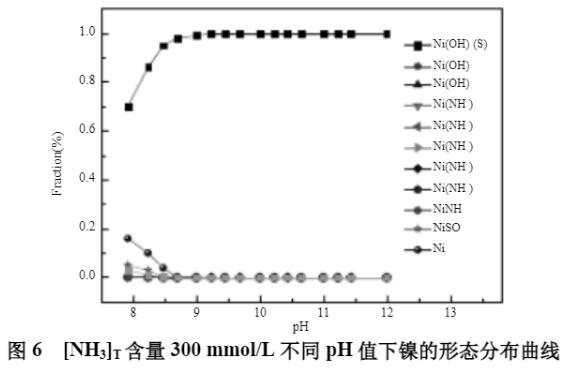
从图5及图6可知,在[NH3]T浓度为300mmol/L时,随着pH值的升高,溶液中的镍逐渐形成Ni(OH)2(s)沉淀,平衡镍浓度逐渐下降,当pH值大于8.7时,溶液中的镍小于0.1mg/L,镍主要以Ni(OH)2(s)沉淀存在,可实现废水中镍的深度脱除。
4.3 深度净化阶段废水系统中镍的形态分析
初始模拟条件:[NH3]T浓度1mmol;[Na2SO4]T浓度0.5mol/L;[Ni2+]T浓度2mg/L;水温30℃。不同pH值下溶液中镍的平衡浓度见图7所示,镍的形态分布曲线见图8。
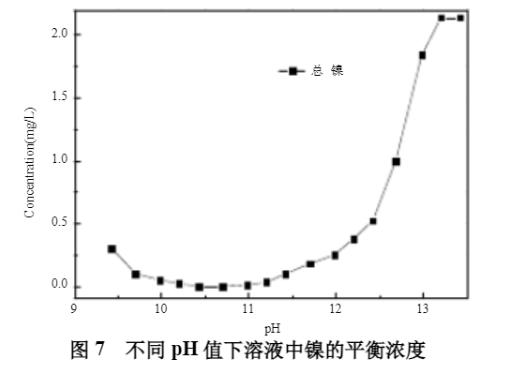
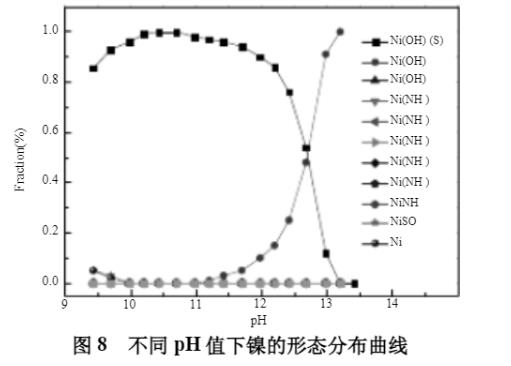
从图7和图8可知,随着pH值的升高,溶液中的平衡镍浓度先降低后升高,在pH值10.6~11.8之间,镍平衡浓度小于0.1mg/L,pH值大于12.8时,镍浓度超过1.0mg/L。因此,在此阶段,废水中的镍可形成Ni(OH)2(s)沉淀,通过精密过滤器B过滤去除,最低可降低至0.1mg/L以下,进一步实现废水中镍的深度脱除。
5、实际废水水质分析
该企业实际废水废水水质见下表所示。由于检测方法等原因,同时氢氧化镍在沉淀的过程中,可通过自吸附作用去除一部分镍,造成该体系中镍的含量存在一定的波动。但是,高盐含镍氨废水体系中的镍可通过pH值、温度等调节,实现镍的深度净化,满足废水处理要求。

6、结论
(1)采用“解络合+蒸氨”工艺,可实现金属镍和氨氮的深度去除。实际废水经“预处理+蒸氨+深度净化”后,氨氮含量<15mg/L,镍含量<0.5mg/L,满足《电池工业污染物排放标准》(GB30484-2013)排放要求。
(2)根据热力学分析,该体系中[NH3]T浓度、pH值对[Ni2+]T起决定作用。体系中[NH3]T浓度的越低,平衡时[Ni2+]T越低,有利于镍的深度去除。由于存在Ni(OH)2在氨水中的返溶现象,[Ni2+]T浓度随pH值的升高,先减少后逐渐增加。
(3)通过PHREEQC热力学软件模拟分析,[NH3]T浓度越低、温度越高、[Na2SO4]T浓度越低,有利于镍的深度处理。在预处理阶段,理论上最低可沉淀至0.mg/L;在蒸氨和深度净化阶段,温度90℃、[NH3]T浓度1mmol、[Na2SO4]T浓度0.5mol/L时,可使镍脱除至0.1mg/L以下,实现镍的深度处理。(来源:湖南艾布鲁环保科技股份有限公司)
